Die psychoaktive Substanz Psilocybin ist das wichtigste Naturprodukt von sogenannten „Zauberpilzen“ der Gattung Psilocybe, was diese Pilze zu einer beliebten Droge macht. Doch auch in der Medizin ist Psilocybin in den letzten Jahren für eine Reihe von psychischen Erkrankungen zunehmend interessant geworden. So zeigten sich vielversprechende Ergebnisse bei der Behandlung von Depressionen, Suchterkrankungen und Angstzuständen. Daher befindet sich Psilocybin als pharmazeutischer Wirkstoff bereits in der fortgeschrittenen klinischen Testung.
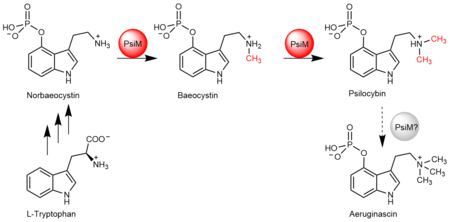
Psilocybin wird von den Pilzen in komplexen biochemischen Prozessen aus der Aminosäure L-Tryptophan gebildet. Dabei spielt das Enzym PsiM, eine Methyltransferase, eine wichtige Rolle. Es katalysiert hintereinander zwei Methylierungsreaktionen, die letzten beiden Schritte der Psilocybin-Herstellung: „Methyltransferreaktionen gibt es in der Natur zwar viele“, sagt Dirk Hoffmeister. Er ist Professor für Pharmazeutische Mikrobiologie an der Friedrich-Schiller-Universität Jena und leitet eine assoziierte Forschungsgruppe am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut (Leibniz-HKI). „Wir haben uns hier aber gefragt, wie die Psilocybinproduktion genau vollendet wird.“
Zwei Enzyme, ein Ursprung
Dazu untersuchte ein Team der Medizinischen Universität Innsbruck um den Kristallographen Bernhard Rupp zusammen mit den Jenaer Forschern das Enzym PsiM sowohl biochemisch als auch mit Hilfe der Röntgenkristallstrukturanalyse. Diese Methode erlaubt eine Darstellung von Proteinen bis auf die atomare Ebene, wobei mehrere Stufen der Reaktion in ultrahoher Auflösung dargestellt werden konnten.
Bei der Untersuchung der Proteinstruktur zeigten sich erstaunliche Ähnlichkeiten im Aufbau zwischen dem Pilzenzym PsiM und Enzymen, die normalerweise für die Modifikation von RNA verantwortlich sind. Obwohl es auch Unterschiede gibt, deutet die große strukturelle Ähnlichkeit darauf hin, dass sich das Pilzenzym aus einer einfach methylierenden RNA-Methyltransferase entwickelt hat. Demnach besaß es früher nur die Fähigkeit, eine einzige Methylgruppe an das Zielmolekül zu heften. „Die Psilocybin-Vorstufe Norbaeocystin, die von PsiM umgesetzt wird, imitiert strukturell einen Teil der RNA, wird aber zweifach methyliert“, so Hoffmeister.
Kleiner Tausch mit großer Wirkung
In weiteren Untersuchungen konnten die Forschenden auch einen entscheidenden Aminosäureaustausch identifizieren, der PsiM während der Evolution die Fähigkeit zur zweifachen Methylierung verlieh. Bei diesem Prozess geschieht der letzte Schritt der gesamten Reaktionskette, der für eine potenzielle biotechnologische Produktion des Wirkstoffs wichtig ist: die Umwandlung des einfach methylierten Zwischenproduktes Baeocystin zum zweifach methylierten Psilocybin.
Ein klares Ende
Die Forschenden fragten sich anschließend, ob PsiM auch Psilocybin durch Anknüpfung einer dritten Methylgruppe zum Aeruginascin umwandeln könne. Aeruginascin ist ein Analogon von Psilocybin, das natürlicherweise in manchen Pilzarten vorkommt. „Die Frage ist nur, wo kommt es her?“, sagt Hoffmeister. In der Wissenschaft herrschte bis dato Uneinigkeit darüber, ob die Verbindung ein Stoffwechselprodukt des Psilocybin-Biosyntheseweges sei und durch PsiM aus Psilocybin hervorgehen könne. Die Studie liefert dazu nun ein klares Ergebnis: „Das geschieht eindeutig nicht“, sagt Hoffmeister. „PsiM ist nicht in der Lage, Psilocybin zu Aeruginascin umzuwandeln.“ Somit kann PsiM zur biosynthetischen Produktion dieses Analogons ausgeschlossen werden. Für die Herstellung von Psilocybin in Mikroorganismen könnte das Enzym künftig aber relevant sein: „Insgesamt können unsere Ergebnisse dabei helfen, neue Varianten von Psilocybin mit verbesserten therapeutischen Eigenschaften zu entwickeln und biotechnologisch herzustellen,“ so Hoffmeister.
Beteiligte Institutionen
Medizinische Universität Innsbruck, Österreich
Colorado School of Mines, Golden, CO, USA
Friedrich-Schiller-Universität Jena, Deutschland
Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie, Jena, Deutschland
k.-k. Hofkristallamt, San Diego, CA, USA
Förderung
Deutsche Forschungsgemeinschaft (DFG)
Österreichischer Wissenschaftsfonds (FWF)
Fulbright-Austrian Marshall Plan Foundation Award
Originalpublikation
Hudspeth J, Rogge K, Dörner S, Müll M, Hoffmeister D, Rupp B, Werten S (2024) Methyl transfer in psilocybin biosynthesis. Nature Communications, https://doi.org/10.1038/s41467-024-46997-z